咨询热线:
157-2080-5229
欢迎光临南京亿隆科技有限公司网站!
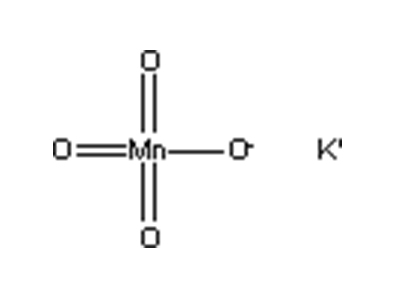
古老的实验室制氯气方法,即用二氧化锰与浓盐酸在加热条件下缓和反应,一直沿用到今天,已有200多年历史,原因就在于此方法较,二氧化锰的氧化性一般不足以将氯离子氧化为爆氯氧化物。从标准电电势看,酸性条件下,高锰酸钾也有将单质氯氧化为ClO3-、ClO4-等化合物的能力,因此高锰酸钾在酸性条件下氧化氯气,也不是不可能发生的,但这仅仅是一个热力学上可行的结论,在动力学上是否可行?是否是单一反应?目前也很难下定论,通过实验证实。酸性锰酸钾溶液是强氧化剂,金属锌则是强还原剂,但锌粉却很难使得酸性锰酸钾溶液褪色,相之下,还原性弱得多的却能使得酸性锰酸钾溶液迅速褪色,这就是典型的热力学(标准电电势)可行但动力学不一定可行的例子。
高锰酸钾是很强的氧化剂,很容易将氯离子氧化为氯气:2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O但从标准电电势看,锰酸钾的氧化性也足以将氯离子氧化为ClO2、Cl2O7等的氧化物。实际上实验室使用锰酸钾和盐酸反应制取氯气,盐酸不宜太浓(1:1盐酸,即约6mol/L盐酸即可),而且要慢慢滴加,不可一下子将大量37盐酸加入锰酸钾中,这样会引起剧烈的反应,甚至有失控炸的危险,与ClO2、Cl2O7等爆氯氧化物的生成不无关系。